|
Una corrente elettrica è costituita da un flusso continuo di elettroni che si spostano all’interno dei conduttori. Pur essendo liberi di muoversi, gli elettroni di un conduttore sono ostacolati nel loro movimento, soprattutto dagli urti con gli atomi del materiale; alla difficoltà più o meno grande con cui avviene il movimento degli elettroni si deve la resistenza elettrica del conduttore.
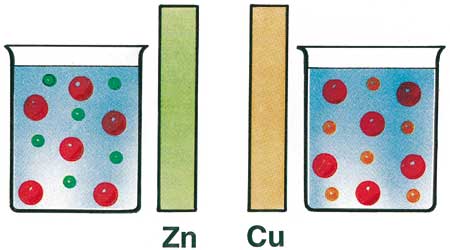
Il funzionamento di una pila si basa sulla proprietà di molte sostanze, tra cui principalmente i metalli, di perdere o acquistare elettroni quando sono poste a contatto di particolari soluzioni. Esistono infatti sostanze (che vengono chiamate elettroliti) le cui molecole, poste in acqua, si scindono in ioni positivi e ioni negativi. Il cloruro di sodio, cioè il comune sale da cucina, è una di queste sostanze. Anche lo zinco (Zn) e il rame (Cu) formano dei sali, per esempio il solfato di zinco e il solfato di rame, che si comportano come elettroliti: il solfato di zinco si scinde in ioni positivi Zn2+ e in ioni solfato negativi formati da un atomo di zolfo e quattro atomi di ossigeno (SO42– è la loro formula chimica). Analogamente, il solfato di rame si scinde in ioni Cu2+ e ioni SO42–. Immergiamo ora una sbarretta di zinco nella soluzione di solfato di zinco e una sbarretta di rame nella soluzione di solfato di rame.
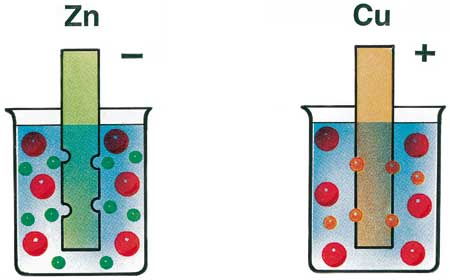
I due metalli si comportano in modo molto differente: lo zinco ha la tendenza a cedere altri ioni Zn2+ alla propria soluzione; il rame, invece, cattura ioni Cu2+ dalla propria soluzione. Sullo zinco rimarranno perciò elettroni liberi in eccesso e la sbarretta si caricherà di elettricità negativa e assumerà un potenziale negativo rispetto alla propria soluzione. Nel rame avverrà l’opposto: ioni Cu2+ si depositeranno sulla sbarretta e questa si caricherà di elettricità positiva e assumerà un potenziale positivo rispetto alla propria soluzione. |