|
|
Un tipo di pila elettrolitica particolarmente semplice si ottiene mettendo in contatto le due soluzioni di solfato di rame e solfato di zinco descritte nella sezione precedente. Il mescolamento delle soluzioni viene rallentato, per esempio, da una parete porosa.
Tra la sbarretta di rame e quella di zinco si stabilirà una differenza di potenziale il cui valore è caratteristico della coppia di metalli ed è detto “forza elettromotrice della pila” (il rame è il polo positivo; lo zinco, quello negativo). Collegando le due sbarrette mediante un filo metallico gli elettroni in eccesso sullo zinco passeranno, lungo il filo, alla sbarretta di rame; un amperometro segnerà il passaggio di corrente.
Al passaggio di elettroni dallo zinco al rame lungo il filo esterno corrisponde il passaggio di ioni tra le due soluzioni, attraverso il condotto poroso. La stessa corrente che circola nel filo fuori dalla pila, circola quindi anche dentro la pila e tutto procede come se la pila prendesse elettroni dal rame e al suo interno li spingesse sullo zinco per farli uscire lungo il circuito, e così via.
La pila è sede di reazioni chimiche e perciò possiamo considerarla un serbatoio di energia chimica. In particolare, lo schema di tale reazione è il seguente.
reazione all’elettrodo di zinco:
Zn 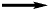 Zn2+ + 2e– Zn2+ + 2e–
reazione all’elettrodo di rame:
Cu2+ + 2e– 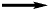 Cu Cu
I due elettroni liberati sulla lamina di zinco per il processo di dissoluzione migrano lungo il conduttore esterno e, giunti sulla lamina di rame, riducono a rame metallico uno ione della soluzione.
La reazione globale, per quanto riguarda i due metalli, può quindi essere rappresentata così:
Zn + Cu2+ 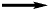 Zn2+ + Cu Zn2+ + Cu
Dopo un certo periodo di funzionamento la corrente cessa (cioè la pila “si scarica”) perché tutti gli ioni Cu2+ inizialmente presenti nella soluzione si sono depositati sulla sbarretta di rame, oppure la sbarretta di zinco si è tutta disciolta: il serbatoio di energia viene a essere esaurito e la reazione che determina il passaggio di corrente non può più aver luogo.
|
|